Abstract
Inhalable, noncombustible cannabis products are playing a central role in the expansion of the medical and recreational use of cannabis. In particular, the practice of “dabbing” with butane hash oil has emerged with great popularity in states that have legalized cannabis. Despite their growing popularity, the degradation product profiles of these new products have not been extensively investigated. The study herein focuses on the chemistry of myrcene and other common terpenes found in cannabis extracts. Methacrolein, benzene, and several other products of concern to human health were formed under the conditions that simulated real-world dabbing. The terpene degradation products observed are consistent with those reported in the atmospheric chemistry literature.
Introduction
Terpenes and terpenoids are present in such a wide diversity of environments (nature, food, cosmetics, pharmaceuticals, and drugs) that their consequences for inhalation toxicology cannot be ignored. Additionally, their inclusion in flavored electronic cigarettes1 and ubiquitous presence in inhalable cannabis products are of particular concern. The medicinal and psychoactive effects of cannabis have been proposed to be enhanced by terpenes, a phenomenon known as the “entourage effect”,2 and these relatively unsubstantiated assertions of benefits have led the cannabis industry to place a heavy emphasis on these aroma compounds.
Terpenoid degradation in the context of cannabis has not been extensively studied;3,4 however, it has attracted attention in the context of atmospheric chemistry.5,6 For instance, the reactions of terpenoids with O3 and NOx are well-known, but they are not directly applicable to e-cigarettes or inhalable cannabis products. However, these and other studies of pyrolysis and combustion of terpenoids should serve as a starting point toward understanding the reaction pathways in consumer vaporization devices. Despite the growing popularity of flavored e-cigarettes and terpene-enriched cannabis extracts, the chemical profiles of their terpene degradation products have not been evaluated in detail.
Of very recent concern is the practice of dabbing, which has emerged as a dangerous and rapidly growing trend in cannabis consumption. It consists of inhaling the vapors produced by placing a small amount of cannabis extract (a “dab”) on a small heated surface (the “nail”), which is connected to a water pipe.7 Its delivery of harmfully large amounts cannabinoids8,9 represents a potential danger to consumers, but little is known about the toxicants the process may produce.
The principal extract used in dabbing is butane hash oil (BHO). BHO is a resinous, nonpolar extract of the cannabis made using butane as a solvent.10 BHO has active ingredient (tetrahydrocannabinol (THC) or cannabidiol) contents ranging between 50 and 90%,8,11 with terpene content ranging from 0.1 to 34% (unpublished). Myrcene is unequivocally the most abundant terpene in cannabis, followed by limonene, linalool, pinene, caryophyllene, and humulene; however, the plant can contain up to 68 additional terpenic compounds in trace amounts.12 Additionally, some consumers increase the terpenoid content by dipping BHO in a vial of terpenes prior to use (“terp dipping”).13
BHO is made by passing butane over cannabis buds and leaves, and subsequently “purging” the butane from the product under vacuum at room temperature or in an oven. Different nuances in its processing can lead to slightly different consistencies, which take on terms such as shatter, budder, crumble, pull-and-snap, wax, and so on. In all of its forms, the extract is a sticky, resinous substance similar to the oleo-resins of other plants.14 Because the process does not involve heating the extract to the point that delta-9-tetrahydrocannabinolic acid (THCA, the native form of this substance found in the plant) decarboxylates (unpublished) into the active THC, BHO is not orally active and must be vaporized for the users to achieve its effects.15
BHO production started out as a dangerous “backyard-chemist” style operation that is famous for causing numerous explosions and house fires. Through the course of legalization, the production has steadily gained sophistication. The most modern, legal extraction laboratories live up to the OSHA standards with full ventilation and butane recovery. Modern techniques also include steps to “de-wax” the product by dissolving the crude BHO in isopropyl alcohol and chilling in a freezer, and, finally, filtering off the precipitated waxes in a process known as winterization. Many subtleties in its production exist, but many remain secretive due to the highly competitive nature of the cannabis marketplace and the general inability of extract producers to file patents due to the drug’s legal status at the federal level.
In addition to butane extraction, supercritical CO2 extraction has gained traction due to the fact that is does not leave any trace of hydrocarbon solvents in the end product.16 The cannabis extract made by this method, colloquially known as CO2 oil, has a lesser viscosity than BHO, a property that allows it to be used in vaporizer pens on its own with no cutting agents. The lesser viscosity is due to the fact that the supercritical extraction process requires the product to be first decarboxylated (heating in an oven at 100+ °C),17 leaving an extract consisting of all THC (an oil at room temperature) and no THCA (a solid at room temperature). CO2 oil is generally more expensive than BHO and mostly present on the market in prefilled vaporizer cartridges and not commonly as a standalone extract for dabbing. Because this extraction method does not leave residual hydrocarbons, it has been named, along with alcohol extracts, as the only allowable medical extracts to be sold under the medical cannabis regulations in New York,18 Minnesota, Ohio, and Pennsylvania.
According to a recent survey,11 the main reasons for using dabs are that less material is needed to get the desired effect and a “cleaner high.” Consumers consider dabbing to be a form of vaporization, and, therefore, view it as easier on the lungs than smoking.19 However, little information exists on the prevalence of dabbing. From 213 BHO extraction laboratories in the 17 states raided in 2014, 2015 saw a steep increase in the number of laboratories raided to 337 in 26 states.20 An analysis of the Twitter content related to dabs found a greater popularity in the states that have legalized recreational and/or medical cannabis.21
Different types of nails, the surface on which vaporization occurs, exist on the market. Use of an electrically controlled nail (“e-nail”) allows temperature control; but, more commonly, users heat the nail (made of titanium, ceramic, or quartz) with a crème brulee torch22 and have no temperature control. A minority of dabbers use lower temperatures to preserve flavor, whereas a majority use higher temperatures to assure complete vaporization with no wasted material. E-nail users posting online cite a preferred temperature around 710 °F (378 °C), but cite a range from 340–482 °C.23−25 Raber et al. reported a dabbing temperature of 300 °C, but this was only an (low) estimate. The boiling point of THC has recently been predicted to be ca. 417 °C,26 but vaporization can occur at temperatures lower than this by the use of a “carb cap” that reduces pressure on its surface during inhalation.27
This study is an initial effort toward assessing the safety of dabbing cannabis extracts. Due to the fact that these consist of a complex mixture, we have begun our focus on terpenoids, the component we predict to be the most thermally labile. To study dabbing, we carefully recreated the inhalation topography and temperatures employed by users. The study described herein is the first to investigate the degradation products from dabbing and is focused on the terpene fraction of the extracts used by consumers.
Results and Discussion
Sample Generation and Product Identification
We investigated the dabbing temperature ranges (TRs, Figure Figure11) inclusive of and beyond the ranges of those reported by the users. The vapor collection and analysis methods were based on those by Jensen et al.28 using an impinger filled with NMR solvent for vapor collection. In the dabbing simulation experiments herein, the vapor generated from the heated ceramic nail connected to a water pipe passed through a cold trap followed by the impinger. The impinger was, in turn, connected to a smoking machine that generated the airflow. Degradation products from myrcene, limonene, linalool, and Fire OG cannabis terpenes, a commercially available mix specifically fabricated for terp dipping, were monitored.11 The presence of methacrolein (MC) and benzene in vapor NMR samples was confirmed by spiking with authentic samples (Supporting Information). Their levels were quantified by NMR using an internal standard.
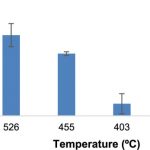 Figure 1 MC (ng) generated in a 40 mg dab using myrcene as a model terpene assuming a 5.9% concentration of terpenes in BHO. Temperature values represent the Tm for each TR. Error bars are determined at the 95% confidence level using the standard deviation of …
Figure 1 MC (ng) generated in a 40 mg dab using myrcene as a model terpene assuming a 5.9% concentration of terpenes in BHO. Temperature values represent the Tm for each TR. Error bars are determined at the 95% confidence level using the standard deviation of …
In addition to the NMR method, the dabbing vapor was collected using an adsorption/thermal desorption (ATD) cartridge and analyzed using an automated adsorption/thermal desorption–gas chromatography–mass spectrometry (ATD–GC–MS) method similar to that in Pankow et al.29 Additional product structures (Scheme 1) were assigned by the GC–MS analysis. Other minor products that have been previously described in the literature30 were also tentatively identified in the chromatographs (Supporting Information). Air blanks were collected and analyzed using each of the NMR and the ATD–GC–MS methods.
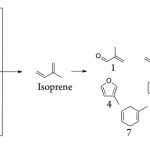 Scheme 1 Terpene Degradation Products Identified via the GC–MS Analysis
Scheme 1 Terpene Degradation Products Identified via the GC–MS Analysis
Temperatures in dabbing experiments were carefully monitored for consistency using a thermographic camera. As the first drop in terpene touched the nail, an initial temperature (Ti) was recorded. Once a 10 s draw concluded, a final temperature (Tf) was recorded (the nail cooled between 50 and 30 °C during the draw due to convection). A median temperature (Tm) was calculated and averaged for each replicate to afford a representative Tm for each TR.
The 1H NMR spectra from the dabbing samples displayed peaks characteristic of a range of organic acid, aldehyde, and aromatic products. The two products appearing in high abundance in the spectra were the toxins benzene and MC (Scheme 1, Table 1). MC is a well-known degradation product of isoprene,5,31,32 which is itself a known degradation product of myrcene33 and other terpenes.34 Benzene, alkyl benzenes, and polycyclic aromatic hydrocarbons are known to form during terpene thermolysis. For example, benzene has been observed as a degradation product in the synthesis of myrcene by the pyrolysis of β-pinene,35 and it is also a product of solanesol pyrolysis.34 Benzene has also been detected in cannabis smoke.36
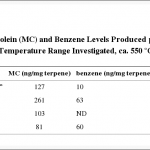 Table 1 Methacrolein (MC) and Benzene Levels Produced per mg Terpene Starting Material When Vaporized at the Highest Temperature Range Investigated, ca. 550 °C (Ti) −500 °C (Tf) Using Single Replicate Experiments
Table 1 Methacrolein (MC) and Benzene Levels Produced per mg Terpene Starting Material When Vaporized at the Highest Temperature Range Investigated, ca. 550 °C (Ti) −500 °C (Tf) Using Single Replicate Experiments
Product Quantification
Given the wide diversity of the terpenes present in BHO, the relatively high abundance of myrcene and the similarity of the products from each of the terpenes studied (Table 1 and Scheme 1), we focused on myrcene as a model terpene in evaluating the effect of temperature on the yields of MC and benzene. Assuming 40 mg as an average size dab,22 each dab contains 2.36 mg of terpenes, which is based on an average concentration of terpenes of 5.9% in BHO (unpublished data). The amount of MC obtained per dab based on these calculations is displayed in Figure Figure11.
Because dabbing topography has not been previously investigated, we chose an inhalation volume of 338 mL and a 10 s duration to assure a more complete collection of vapor. The concentrations of MC in ppb per dab in this regime are 185 ± 11 ppb at Tm = 526 °C, 157 ± 2 ppb at Tm = 455 °C, 131 ± 9 ppb at Tm = 403 °C, and undetectable at Tm = 322 °C.
Benzene was not detected below the highest TR. Using the same rationale as above for MC emission, one dab of BHO delivers 17 ng of benzene. Represented as a concentration in the draw volume, this value is 15 ± 1.8 ppb.
Degradant Toxicology
MC’s property as a noxious irritant is unsurprising due to its structural similarity to acrolein, a powerful pulmonary irritant37 and an air pollutant of great concern. Ambient concentrations of MC outside of Stockholm were determined to be 0.06 ppb, whereas those at different urban locations in Stockholm were 0.11, 0.13, 0.19, and 0.71 ppb.38 MC’s effect on the respiratory tract in mice has shown it to be a potent irritant, indicating its threshold limit value should not exceed 0.3 ppm.39 Nøjgaard et al. reported changes in the blink frequency during eye exposure to MC at a concentration of 100 ppb and proposed a LOEL of 286 ppb.40 These conflicting reports indicate that the safe levels of MC are yet to be determined.
Unlike MC, the toxicology of benzene has been thoroughly evaluated. Although benzene is a ubiquitous pollutant, the concentrations of benzene found in the dabbing terpenes at the highest TR are far greater than those found in ambient air. The average concentration of benzene, a potent carcinogen, in U.S. air, measured over 137 different sites is 0.313 ppb (313 ppt),3,41 and is correspondingly the “largest single known cancer-risk air toxic (sic).”42
Degradant Formation Mechanism
We propose that the formation of MC and benzene occurs via isoprene as an intermediate (Scheme 1). The GC–MS spectra of limonene, linalool, and myrcene all displayed significant peaks tentatively assigned to isoprene, which suggests that these terpenes, the major terpenes in BHO, break down to their isoprene monomers before further degradation.
Studies of the atmospheric chemistry of isoprene have shown that it reacts with hydroxyl radicals and O2 to form not only MC and HCHO but also methyl vinyl ketone and 3-methylfuran. The GC–MS analysis of each pure terpene studied afforded a tentative identification with a high match quality of MC, methyl vinyl ketone, and 3-methylfuran, as well as 1,3-butadiene and several cyclic and acyclic dienes, polyenes, and aromatics (Scheme 1 and Supporting Information).
Limitations
The main limitation of this study is the fact that the concentrations of MC and benzene determined are likely underestimated. One reason may be the relatively large draw volume used. In addition, the temperature-dependent concentration values were extrapolated from myrcene, which afforded the lowest yield of degradation products of all of the terpenes investigated. Another factor potentially contributing to the underestimation of yields is transfer inefficiency resulting in the potential losses of terpenes and their products. For example, the average myrcene recovery (8.7 ± 0.7 mg) was low compared to the amount delivered onto the nail (59.6 mg). Although this low yield of terpenes in the NMR sample was initially attributed to their limited solubility in DMSO-d6, dabbing experiments using CDCl3 also had low yield by NMR. This may not be due entirely to degradation. Transfer inefficiency in dabbing has been previously described.22
Conclusions
Given the widespread legalization of cannabis in the United States, it is imperative to study the full toxicology of its consumption to guide future policy. The results of these studies clearly indicate that dabbing, although considered a form of vaporization, may in fact deliver significant amounts of toxic degradation products. The difficulty users find in controlling the nail temperature put users at risk of exposing themselves to not only methacrolein but also benzene. Additionally, the heavy focus on terpenes as additives seen as of late in the cannabis industry is of great concern due to the oxidative liability of these compounds when heated. This research also has significant implications for flavored e-cigarette products due to the extensive use of terpenes as flavorings. Future research will also be directed toward assessing the contribution of terpenoids to the existing toxicant formation in e-cigarettes. Additionally, the methods discussed herein will also be used to further study the degradation of cannabis extracts used in dabbing and cannabis e-cigarettes.
Methods
Materials
Terpenes included myrcene ≥95%, stabilized, FCC, FG (Sigma-Aldrich); (R)-(+)-limonene analytical standard (Sigma-Aldrich); linalool ≥97%, FCC, FG; and Fire OG terpene mix (Blue River Extracts).
NMR Experiments
Air is drawn at a constant rate using and the Single Cigarette Smoking Machine (SCSM-STEP, CH Technologies) calibrated to pull 338 mL air during a 10 s dab. A HIVE Domeless Element 10 mm ceramic nail (HIVE Ceramics) was attached to a small dab water pipe (Zion Cannabis in Portland, OR). For each separate experiment, the water pipe was filled with 20 mL of fresh 200 ppm solution of NaCl Biological, Certified Crystalline (Fisher Scientific) in HPLC grade water (Honeywell).
Terpene (15 μL) was delivered per dab using a Hamilton 50 μL analytical syringe. Five dabs were done per experiment. The vapor was collected through a cold trap chilled with isopropyl alcohol/dry ice at −77 °C, proceeded by an impinger containing 750 μL of DMSO-d6 + 0.05% v/v tetramethylsilane (99.9%, Cambridge Isotope). After the experiment was concluded, the cold trap was washed with the NMR solvent in the impinger and collected quantitatively using an Eppendorf P1000 pipette in an NMR tube. The water pipe and the cold trap were connected by 5 cm of 1/2 in. outer diameter ACF0027-F Tygon S3 E-3603. The end connected to the water pipe was wrapped in Teflon tape to make it fit snugly. The cold trap and the impinger were connected by 3.5 cm of 1/2 in. outer diameter ACF0027-F Tygon S3 E-3603. The impinger and the SCSM were connected by 5 cm of 3/8 in. outer diameter ACF0017-F Tygon S3 E-3603. The tubing was discarded after every experiment, so sorptive losses were consistent with every experiment.
All of the NMR samples were spiked with 10 μL of a 17.33 mM solution of 2,3,5,6-tetrachloronitrobenzene (TCI Chemicals) in DMSO-d6 using an Eppendorf P10 pipette. This standard solution was made by adding 11.23 mg of 2,3,5,6-tetrachloronitrobenzene to 3 mL of DMSO-d6.
Myrcene dab NMR experiments at each TR (Figure Figure11) were performed in triplicate. Terpene experiments shown in Table 1 were performed once each. The exact conditions used in recording the NMR spectra are presented in the SI.
ATD–GC–MS
The same water pipe (containing 20 mL 200 ppm solution of NaCl) and the same ceramic nail were connected to an ATD cartridge with 5 cm of 1/2 in. outer diameter ACF0027-F Tygon S3 E-3603 wrapped in the Teflon tape to make a seal and then attached to 5 cm of 3.5 cm of 3/8 in. outer diameter ACF0027-F Tygon S3 E-3603, also wrapped with Teflon tape on the end to assure an air-tight seal. The other end of the ATD cartridge was connected to the SCSM-STEP using 5 cm of 3.5 cm of 3/8 in. outer diameter ACF0027-F Tygon S3 E-3603. The ATD cartridges used contained 100 mg of 35/60 mesh Tenax TA and 200 mg of 60/80 mesh Carbograph 1 TD (Camsco Inc., Houston, TX). The same dabbing topography used in the NMR experiments were used in the ATD cartridge sample collections. This high flow rate exceeds that normally used for these cartridges, but this was allowed due to the fact that these experiments were only used for product identification and not quantification. The conditions used in the ATD cartridge analysis are explained in the SI.
Thermography
The temperature of the nail was acquired real time by the infrared thermography using an FLIR T450sc 2.0 (FLIR Systems). The emissivity of the ceramic nail was determined experimentally to be 0.9 by comparing it to the known value of insulating electrical tape, 0.97. The reflected temperature was determined by the reflector method to be 23 °C. The TRs used in the NMR experiments are shown in Figure Figure11, and the TR used in the ATD–GC–MS experiment was the second hottest TR with a Tm of 455 °C. All of the temperature data for each experiment are presented in the SI.
Acknowledgments
Dr. Jorge Escobedo provided the guidance and useful discussion in the experiments and during manuscript drafting. Dr. David Peyton provided the guidance and useful discussion in the NMR methods used. Tim Frasca reviewed the manuscript for content and style.
References
- Tierney P. A.; Karpinski C. D.; Brown J. E.; Luo W.; Pankow J. F. Flavour chemicals in electronic cigarette fluids. Tob. Control 2016, 25, e10–e1510.1136/tobaccocontrol-2014-052175. [PubMed] [Cross Ref]
- Russo E. B. Taming THC: potential cannabis synergy and phytocannabinoid-terpenoid entourage effects. Br. J. Pharmacol. 2011, 163, 1344–136410.1111/j.1476-5381.2011.01238.x. [PubMed] [Cross Ref]
- do Monte D. S.; Tenório J. A. B.; Bastos I. V. G. A.; Mendonça F. d. S.; Neto J. E.; da Silva T. G.; Ramos C. S. Chemical and biological studies of beta-carotene after exposure to Cannabis sativa smoke. Toxicol. Rep. 2016, 3, 516–52210.1016/j.toxrep.2016.06.001. [PubMed] [Cross Ref]
- Iqbal M. S.; Khan M. U. A.; Akbar J.; Shad M. A.; Masih R.; Chaudhary M. T. Isoconversional thermal and pyrolytic GC-MS analysis of street samples of hashish. J. Anal. Appl. Pyrolysis 2016, 122, 175–18210.1016/j.jaap.2016.09.026. [Cross Ref]
- Atkinson R. Gas Phase Tropospheric Chemistry of Organic Compounds: A Review. Atmos. Environ., Part A 1989, 24, 1–4110.1016/0960-1686(90)90438-S. [Cross Ref]
- Calogirou A.; Larsen B. R.; Kotzias D. Gas-phase terpene oxidation products: a review. Atmos. Environ. 1999, 33, 1423–143910.1016/S1352-2310(98)00277-5. [Cross Ref]
- Stogner J. M.; Miller B. L. The Dabbing Dilemma: A Call for Research on Butane Hash Oil and Other Alternate Forms of Cannabis Use. Subst. Abuse 2015, 36, 393–39510.1080/08897077.2015.1071724. [PubMed] [Cross Ref]
- Pierre J. M.; Gandal M.; Son M. Cannabis-induced psychosis associated with high potency “wax dabs”. Schizophr. Res. 2016, 172, 211–21210.1016/j.schres.2016.01.056. [PubMed] [Cross Ref]
- Murray R. M.; Quigley H.; Quattrone D.; Englund A.; Di Forti M. Traditional marijuana, high-potency cannabis and synthetic cannabinoids: increasing risk for psychosis. World Psychiatry 2016, 15, 195–20410.1002/wps.20341. [PubMed] [Cross Ref]
- Stogner J. M.; Miller B. L. Assessing the Dangers of “Dabbing”: Mere Marijuana or Harmful New Trend?. Pediatrics 2015, 136, 1–310.1542/peds.2015-0454. [PubMed] [Cross Ref]
- Loflin M.; Earleywine M. A new method of cannabis ingestion: the dangers of dabs?. Addict. Behav. 2014, 39, 1430–143310.1016/j.addbeh.2014.05.013. [PubMed] [Cross Ref]
- Ross S. A.; ElSohly M. A. The volatile oil composition of fresh and air-dried buds of Cannabis sativa. J. Nat. Prod. 1996, 59, 49–5110.1021/np960004a. [PubMed] [Cross Ref]
- danner1620 Terp Dippin’ Kosher Kush Rosin with Blue River Extracts
- Stogner J. M.; Miller B. L. The Dabbing Dilemma: A Call for Research on Butane Hash Oil and Other Alternate Forms of Cannabis Use. Subst. Abuse 2015, 36, 393–39510.1080/08897077.2015.1071724. [PubMed] [Cross Ref]
- ElSohly M. A.. Marijuana and the Cannabinoids, 1st ed.; Humana Press: NJ, 2007.
- Perrotin-Brunel H.; Perez P. C.; van Roosmalen M. J. E.; van Spronsen J.; Witkamp G. J.; Peters C. J. Solubility of Delta(9)-tetrahydrocannabinol in supercritical carbon dioxide: Experiments and modeling. J. Supercrit. Fluids 2010, 52, 6–1010.1016/j.supflu.2009.12.001. [Cross Ref]
- Perrotin-Brunel H.; van Roosmalen M. J. E.; van Spronsen J.; Verpoorte R.; Peters C. J.; Witkamp G. J. Supercritical fluid extraction of cannabis: experiments and modelling of the process design. ISASF-Graz 2010, 1–6.
- Manufacturing Requirements for Approved Medical Marihuana Products. Official Compilation of Codes, Rules and Regulations of the State of New York, Part 1004, Section 11(b), Title 10, 2017.
- Gieringer D.; St. Laurent J.; Goodrich S. Cannabis Vaporizer Combines Efficient Delivery of THC with Effective Suppression of Pyrolytic Compounds. J. Cannabis Ther. 2004, 4, 7–2710.1300/J175v04n01_02. [Cross Ref]
- 2015 National Drug Threat Assessment Summary; Report Number DEA-DCT-DIR008-16; US Department of Justice, United States Drug Enforcement Agency; Homeland Security Digital Library, 2015.
- Daniulaityte R.; Nahhas R. W.; Wijeratne S.; Carlson R. G.; Lamy F. R.; Martins S. S.; Boyer E. W.; Smith G. A.; Sheth A. “Time for dabs”: Analyzing Twitter data on marijuana concentrates across the U.S. Drug Alcohol Depend. 2015, 155, 307–31110.1016/j.drugalcdep.2015.07.1199. [PubMed] [Cross Ref]
- Raber J. C.; Elzinga S.; Kaplan C. Understanding dabs: contamination concerns of cannabis concentrates and cannabinoid transfer during the act of dabbing. J. Toxicol. Sci. 2015, 40, 797–80310.2131/jts.40.797. [PubMed] [Cross Ref]
- Burns D.. What’s Your Preferred Enail Temp? https://www.reddit.com/r/CannabisExtracts/comments/30mj24/whats_your_preferred_enail_temp/ (accessed July 18, 2017).
- MFletcher I.. Is There a Consensus Temp for Low Temps Dabs on an Enail? https://www.reddit.com/r/enail/comments/4gjznx/is_there_a_consensus_temp_for_low_temp_dabs_on_an/ (accessed July 18, 2017).
- Propanekush What Temperature are you Dabbing at? What Type of Nail? https://www.reddit.com/r/CannabisExtracts/comments/3onqt8/what_temperature_are_you_dabbing_at_what_type_of/ (accessed July 18, 2017).
- Tara M.; Lovestead T. J. B. Determination of Cannabinoid Vapor Pressures to Aid in Vapor Phase Detection of Intoxication. Forensic Chem. 2017, 5, 79–8510.1016/j.forc.2017.06.003. [Cross Ref]
- Black S.. Why Carb Cap? Elevate Your Dabbing. http://hightimes.com/culture/why-carb-cap-elevate-your-dabbing/ (accessed July 18, 2016).
- Jensen R. P.; Strongin R. M.; Peyton D. H. Solvent Chemistry in the Electronic Cigarette Reaction Vessel. Sci. Rep. 2017, 7, 4254910.1038/srep42549. [PubMed] [Cross Ref]
- Pankow J. F.; Kim K.; McWhirter K. J.; Luo W.; Escobedo J. O.; Strongin R. M.; Duell A. K.; Peyton D. H. Benzene formation in electronic cigarettes. PLoS One 2017, 12, e017305510.1371/journal.pone.0173055. [PubMed] [Cross Ref]
- McGraw G. W.; Hemingway R. W.; Ingram L. L.; Canady C. S.; McGraw W. B. Thermal degradation of terpenes: Camphene, Delta(3)-carene, limonene, and alpha-terpinene. Environ. Sci. Technol. 1999, 33, 4029–403310.1021/es9810641. [Cross Ref]
- Carter W. P. L. Condensed atmospheric photooxidation mechanisms for isoprene. Atmos. Environ. 1996, 30, 4275–429010.1016/1352-2310(96)00088-X. [Cross Ref]
- Palen E. J.; Allen D. T.; Pandis S. N.; Paulson S. E.; Seinfeld J. H.; Flagan R. C. Fourier Transform Infrared Analysis of Aerosol Formed in the Photo-Oxidation of Isoprene and [beta]-pinene. Atmos. Environ., Part A 1992, 26, 1239–125110.1016/0960-1686(92)90385-X. [Cross Ref]
- Egloff G.; Herrman M.; Levinson B. L.; Dull M. F. Thermal reactions of terpene hydrocarbons. Chem. Rev. 1934, 14, 287–38310.1021/cr60049a001. [Cross Ref]
- Britt P. F.; Buchanan A. C. III; Owens C. V. Jr. Mechanistic Investigation into the Formation of Polycyclic Aromatic Hydrocarbons from the Pyrolysis of Terpenes. Prepr. Pap.-Am. Chem. Soc., Div. Fuel Chem. 2004, 49, 868–871.
- Kolicheski M. B.; Cocco L. C.; Mitchell D. A.; Kaminske M. Synthesis of myrcene by pyrolysis of [beta]-pinene: Analysis of decomposition reactions. J. Anal. Appl. Pyrolysis 2007, 80, 92–10010.1016/j.jaap.2007.01.005. [Cross Ref]
- Moir D.; Rickert W. S.; Levasseur G.; Larose Y.; Maertens R.; White P.; Desjardins S. A comparison of mainstream and sidestream marijuana and tobacco cigarette smoke produced under two machine smoking conditions. Chem. Res. Toxicol. 2008, 21, 494–50210.1021/tx700275p. [PubMed] [Cross Ref]
- Wang H. T.; Hu Y.; Tong D.; Huang J.; Gu L.; Wu X. R.; Chung F. L.; Li G. M.; Tang M. S. Effect of carcinogenic acrolein on DNA repair and mutagenic susceptibility. J. Biol. Chem. 2012, 287, 12379–1238610.1074/jbc.M111.329623. [PubMed] [Cross Ref]
- Jonsson A.; Persson K. A.; Grigoriadis V. Measurements of Some Low Molecular-Weight Oxygenated, Aromatic, and Chlorinated Hydrocarbons in Ambient Air and in Vehicle Emissions. Environ. Int. 1985, 11, 383–39210.1016/0160-4120(85)90033-9. [Cross Ref]
- Larsen S. T.; Nielsen G. D. Effects of methacrolein on the respiratory tract in mice. Toxicol. Lett. 2000, 114, 197–20210.1016/S0378-4274(99)00300-8. [PubMed] [Cross Ref]
- Nøjgaard J. K.; Christensen K. B.; Wolkoff P. The effect on human eye blink frequency of exposure to limonene oxidation products and methacrolein. Toxicol. Lett. 2005, 156, 241–25110.1016/j.toxlet.2004.11.013. [PubMed] [Cross Ref]
- EPA’s Report on the Environment; Ambient Concentrations of Selected Air Toxics. Exhibit 3; US Environmental Protection Agency, 2014.
- George B. J.; Schultz B. D.; Palma T.; Vette A. F.; Whitaker D. A.; Williams R. W. An evaluation of EPA’s National-Scale Air Toxics Assessment (NATA): Comparison with benzene measurements in Detroit, Michigan. Atmos. Environ. 2011, 45, 3301–330810.1016/j.atmosenv.2011.03.031. [Cross Ref]
Source : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5623941/
Traduction partielle à l’aide de Google – Merci à Raphael pour son travail:
Résumé
Les produits du cannabis inhalables et incombustibles jouent un rôle central dans l’expansion de l’usage médical et récréatif du cannabis. En particulier, la pratique consistant à «tamponner» (dabbing) avec de l’huile de haschich au butane a émergé avec une grande popularité dans les États qui ont légalisé le cannabis. Malgré leur popularité croissante, les profils de produits de dégradation de ces
nouveaux produits n’ont pas été étudiés en profondeur. L’étude se concentre sur la chimie du myrcène et d’autres terpènes communs trouvés dans les extraits de cannabis. La méthacroléine, le benzène et plusieurs autres produits préoccupants pour la santé humaine ont été formés dans des conditions simulant le dabbing du monde réel. Les produits de dégradation du terpène observés sont en accord avec ceux rapportés dans la littérature sur la chimie atmosphérique.
Introduction
Les terpènes et les terpénoïdes sont présents dans des environnements si divers (nature, alimentation, cosmétiques, produits pharmaceutiques et médicaments) que leurs conséquences sur la toxicologie par inhalation ne peuvent être ignorées. De plus, leur inclusion dans les cigarettes électroniques aromatisées1 et leur présence omniprésente dans les produits à base de cannabis inhalable sont particulièrement préoccupantes. Les effets médicinaux et psychoactifs du cannabis seraient renforcés par les terpènes, un phénomène connu sous le nom d ‘«effet entourage» 2, et ces affirmations relativement non fondées de bénéfices ont conduit l’industrie du cannabis à mettre fortement l’accent sur ces composés aromatiques.
La dégradation des terpénoïdes dans le contexte du cannabis n’a pas été étudiée de manière
approfondie3,4; cependant, elle a attiré l’attention dans le contexte de la chimie atmosphérique5,6. Par exemple, les réactions des terpénoïdes avec O3 et NOx sont bien connues, mais elles ne sont pas directement applicables aux cigarettes électroniques ou aux produits à base de cannabis inhalable. Cependant, ces études et d’autres sur la pyrolyse et la combustion des terpénoïdes devraient servir de point de départ pour comprendre les voies de réaction dans les dispositifs de vaporisation grand public. Malgré la popularité croissante des e-cigarettes aromatisées et des extraits de cannabis enrichis
en terpène, les profils chimiques de leurs produits de dégradation des terpènes n’ont pas été évalués en détail.
La pratique du dabbing, qui est devenue une tendance dangereuse et en croissance rapide dans la consommation de cannabis, est très préoccupante. Elle consiste à inhaler les vapeurs produites en plaçant une petite quantité d’extrait de cannabis (un « dab ») sur une petite surface chauffée (le « clou »), qui est reliée à une conduite d’eau.7 Son administration de quantités importantes de cannabinoïdes8, 9
représente un danger potentiel pour les consommateurs, mais on sait peu de choses sur les substances toxiques que le procédé peut produire.
L’extrait principal utilisé pour dabber est l’huile de haschisch butane (BHO). BHO est un extrait résineux nonpolaire de cannabis fabriqué avec du butane comme solvant10. BHO a des teneurs
en ingrédient actif (tétrahydrocannabinol (THC) ou cannabidiol comprises entre 50 et 90%, 8,11
avec une teneur en terpène allant de 0,1 à 34% (non publié). Le myrcène est sans équivoque le
terpène le plus abondant dans le cannabis, suivi par le limonène, le linalol, le pinène, le caryophyllène et l’humulène; cependant, la plante peut contenir jusqu’à 68 composés terpéniques supplémentaires en quantités infimes.12 De plus, certains consommateurs augmentent la teneur en terpénoïdes en plongeant le BHO dans un flacon de terpènes avant utilisation («terp dip») 13.
Le BHO est obtenu en faisant passer du butane sur des bourgeons et des feuilles de cannabis, puis en « purgeant » le butane du produit sous vide à température ambiante ou dans un four. Différentes
nuances dans son traitement peuvent conduire à des consistances légèrement différentes, qui prennent des termes tels que briser, budder, crumble, pull-and-snap, cire, et ainsi de suite.
Sous toutes ses formes, l’extrait est une substance collante et résineuse semblable aux oléo-résines d’autres plantes.14 Parce que le processus n’implique pas de chauffer l’extrait au point que l’acide delta-9-tétrahydrocannabinolique (THCA, la forme native de cette substance trouvée dans la plante)
décarboxylates (non publié) dans le THC actif, le BHO n’est pas actif par voie orale et doit être vaporisé pour que les utilisateurs atteignent ses effets.
La production de BHO a commencé comme une opération dangereuse de type «cour-chimiste» qui
est célèbre pour avoir causé de nombreuses explosions et incendies de maisons. Au cours de la légalisation, la production a progressivement gagné en sophistication. Les laboratoires d’extraction légaux les plus modernes respectent les normes de l’OSHA en matière de ventilation et de récupération du butane. Les techniques modernes comprennent également des étapes pour « dé-cirer » le produit en dissolvant le BHO brut dans de l’alcool isopropylique et en le refroidissant dans un congélateur, et, finalement, en filtrant les cires précipitées dans un procédé connu sous le nom d’hivérisation. Beaucoup de subtilités dans sa production existent, mais beaucoup restent secrètes en raison de la nature hautement concurrentielle du marché du cannabis et de l’incapacité générale des producteurs d’extraits à déposer des brevets en raison du statut juridique de la drogue au niveau fédéral.
En plus de l’extraction du butane, l’extraction du CO2 supercritique a gagné en traction du fait
qu’elle ne laisse aucune trace de solvants hydrocarbonés dans le produit final. 16 L’extrait de cannabis fabriqué par cette méthode, connu sous le nom d’huile de CO2, a une viscosité inférieure à celle de BHO, une propriété qui lui permet d’être utilisé seul dans des stylos à vaporiser sans agent de coupure. La viscosité moindre est due au fait que le procédé d’extraction supercritique exige que le produit
soit d’abord décarboxylé (chauffage dans un four à 100 °C), 17 laissant un extrait constitué entièrement de THC (une huile à température ambiante) et aucun THCA (solide à température ambiante). L’huile de CO2 est généralement plus chère que BHO et surtout présente sur le marché dans les cartouches de vaporisateur pré-remplies et pas communément comme un extrait autonome pour tamponner. Parce que cette méthode d’extraction ne laisse pas d’hydrocarbures résiduels, elle a été nommée, avec des extraits d’alcool, comme les seuls extraits médicaux autorisés à être vendus selon les règlements de cannabis médical à New York, 18 Minnesota, Ohio, et Pennsylvanie.
Selon une récente enquête, 11 les raisons principales de l’utilisation des tampons sont que moins de matériel est nécessaire pour obtenir l’effet désiré et l’obtention d’un « meilleur high ». Les consommateurs prennent le dabbing pour une sorte de vaporisation, et, par conséquent, le considèrent plus doux pour les poumons que le fait de fumer.19 Cependant, il existe peu d’information sur la prévalence du dabbing. Des 213 laboratoires d’extraction de BHO dans les 17 États qui ont subi un raid en 2014, 2015 a vu une forte augmentation du nombre de laboratoires attaqués : 337 dans 26 États 20. Une analyse du contenu Twitter lié aux dabs a trouvé une plus grande popularité dans les États qui ont
légalisé cannabis récréatif et / ou médical.21
Différents types de clous, la surface sur laquelle la vaporisation se produit, existent sur le marché. L’utilisation d’un clou à commande électrique (« e-nail ») permet le contrôle de la température ; mais, plus communément, les utilisateurs chauffent le clou (en titane, en céramique ou en quartz) avec une lampe à crème brûlée22 et n’ont aucun contrôle de température. Une minorité de dabbers utilisent des
températures plus basses pour préserver la saveur, tandis qu’une majorité utilise des températures plus élevées pour assurer une vaporisation complète sans gaspillage de matière.
Les utilisateurs d’E-nail postant en ligne citent une température préférée autour de 378 °C (710
°F), mais citent une plage allant de 340 à 482 °C.23-25 Raber et al. ont signalé une température
de dabbing de 300 °C, mais ce n’était qu’une estimation (faible). Le point d’ébullition du THC a été récemment prédit pour être à environ 417 °C, mais la vaporisation peut se produire à des températures plus basses que celle-ci en utilisant un «bouchon de carburateur» qui réduit la pression sur sa surface pendant l’inhalation.27
Cette étude est un premier effort pour évaluer l’innocuité des tampons de cannabis. En raison du
fait que ceux-ci consistent en un mélange complexe, nous avons commencé à nous concentrer
sur les terpénoïdes, le composant que nous pensons être le plus thermiquement labile. Pour
étudier le dabbing, nous avons soigneusement recréé la topographie par inhalation et les
températures utilisées par les utilisateurs. L’étude décrite ici est la première à examiner les produits de dégradation par dabbing et se concentre sur la fraction terpénique des extraits utilisés par les consommateurs.
Résultats et discussion
Séparation de l’échantillon et identification du produit
Nous avons étudié les plages de température de dabbing (TRs, Figure Figure11) les plages de celles rapportées par les utilisateurs. Les méthodes de collecte et d’analyse de la vapeur ont été basées sur celles de Jensen et al.28 en utilisant un impacteur rempli de solvant RMN pour la collecte de la vapeur. Dans les expériences de simulation de dabbing présentées ici, la vapeur générée à partir du clou en céramique chauffé connecté à un tuyau d’eau a traversé un piège à froid suivi de l’impacteur. L’impacteur était à son tour connecté à une machine à fumer qui générait le flux d’air. On a surveillé les produits de dégradation des terpènes de cannabis myrcène, limonène, linalol et Fire OG, un mélange disponible dans le commerce spécialement conçu pour le trempage terp.11 La présence de méthacroléine (MC) et de benzène dans les échantillons de RMN a été confirmée par des échantillons authentiques (renseignements à l’appui). Leurs niveaux ont été quantifiés par RMN en utilisant un étalon interne.
Figure 1 MC (ng) généré dans un dab 40 mg en utilisant le myrcène comme un modèle terpène en
supposant une concentration de 5,9% de terpènes dans BHO. Les valeurs de température représentent
le Tm pour chaque TR. Les barres d’erreur sont déterminées au niveau de confiance de 95% en utilisant l’écart type de …
En plus de la méthode RMN, la vapeur tamponnée a été recueillie en utilisant une cartouche
d’adsorption / désorption thermique (ATD) et analysée en utilisant une méthode d’adsorption / désorption thermique-chromatographie en phase gazeuse-spectrométrie de masse (ATD-GC-MS)
similaire à celle de Pankow et al.29 Des structures de produit supplémentaires (Schéma 1)
ont été attribuées par l’analyse GC-MS. D’autres produits mineurs décrits précédemment dans la
littérature30 ont aussi été provisoirement identifiés dans les chromatographes (Informations à l’appui). Des blancs d’air ont été recueillis et analysés en utilisant chacune des méthodes RMN et ATD-GC-MS.
Schéma 1 Produits de dégradation de terpène identifiés par l’analyse CG-SM
Les températures dans les expériences de tamponnage ont été soigneusement surveillées pour la cohérence en utilisant une caméra thermographique. Lorsque la première goutte de terpène a touché le clou, une température initiale (Ti) a été enregistrée. Une fois un tirage de 10 s conclu, une température finale (Tf) a été enregistrée (le clou refroidi entre 50 et 30 °C pendant le tirage dû à la convection).
Une température médiane (Tm) a été calculée et moyennée pour chaque réplique afin d’obtenir une
Tm représentative pour chaque TR.
Les spectres RMN 1H provenant des échantillons tamponnants ont montré des pics caractéristiques
d’une plage d’acide organique , d’aldéhyde et de produits aromatiques. Les deux produits apparaissant en grande abondance dans les spectres étaient les toxines benzène et MC (schéma 1, tableau 1). MC est un produit de dégradation bien connu de l’isoprène, 5,31,32, qui est lui-même un produit de dégradation connu du myrcne33 et d’autres terpènes34. On sait que le benzène, les alkylbenzènes et les
hydrocarbures aromatiques polycycliques se forment pendant la thermolyse des terpènes. Par exemple, le benzène a été observé comme produit de dégradation dans la synthèse du myrcène par la
pyrolyse du ß-pinène35, et il est également un produit de la pyrolyse du solanesol34. Le benzène
a également été détecté dans la fumée de cannabis36.
Tableau 1 Niveaux de méthacroléine (MC) et de benzène produits par mg Terpène Matière de départ
lors de la vaporisation à la plage de température la plus élevée étudiée, ca. 550 ° C (Ti) -500 ° C
(Tf) en utilisant des expériences à une seule réplique
Quantification du produit
Étant donné la grande diversité des terpènes présents dans BHO, l’abondance relativement élevée de myrcène et la similarité des produits de chacun des terpènes étudiés (Tableau 1 et Schéma 1), nous nous sommes concentrés sur le myrcène comme terpène modèle pour évaluer l’effet de température sur les rendements de MC et de benzène. En supposant 40 mg en tant que dab de taille moyenne, 22 chaque dab contient 2,36 mg de terpènes, ce qui est basé sur une concentration moyenne de terpènes de 5,9% dans BHO (données non publiées). La quantité de MC obtenue par dab sur la base de ces calculs est affichée sur la Figure 11.
Parce que la topographie du dabbing n’a pas été étudiée précédemment, nous avons choisi un volume
d’inhalation de 338 ml et une durée de 10 s pour assurer une collecte plus complète de la vapeur.
Les concentrations de MC en ppb par dab dans ce régime sont de 185 ± 11 ppb à Tm = 526 ° C, 157 ±
2 ppb à Tm = 455 ° C, 131 ± 9 ppb à Tm = 403 ° C, et indétectables à Tm = 322 ° C.Le benzène n’a pas été détecté en dessous du TR le plus élevé. En utilisant la même logique que ci-dessus pour les émissions de MC, une goutte de BHO fournit 17 ng de benzène. Représentée comme une concentration dans le volume de tirage, cette valeur est de 15 ± 1,8 ppb.
Toxicologie de dégradation
La propriété de MC en tant qu’irritant nocif n’est pas surprenante en raison de sa similarité
structurelle avec l’acroléine, un puissant irritant pulmonaire37 et un polluant atmosphérique très préoccupant. Les concentrations ambiantes de MC à l’extérieur de Stockholm ont été déterminées à 0,06 ppb, tandis que celles observées dans différents sites urbains de Stockholm étaient de 0,11, 0,13, 0,19 et 0,71 ppb.38 L’effet de MC sur les voies respiratoires chez les souris a démontré un puissant irritant, indiquant que sa valeur limite ne doit pas dépasser 0,3 ppm.39 Nøjgaard et al. ont signalé des changements dans la fréquence de clignotement pendant l’exposition des yeux à MC à une concentration de 100 ppb et ont proposé une DMEO de 286 ppb.40 Ces rapports contradictoires indiquent que les niveaux sans danger de MC doivent encore être déterminés.
Contrairement à MC, la toxicologie du benzène a été soigneusement évaluée. Bien que le benzène
soit un polluant omniprésent, les concentrations de benzène trouvées dans les terpènes tamponants
au TR le plus élevé sont beaucoup plus élevées que celles trouvées dans l’air ambiant. La concentration moyenne de benzène, un puissant cancérogène dans l’air des États-Unis, mesurée sur 137 sites différents, est de 0,313 ppb (313 ppt), 3,41 et est de ce fait la «plus grande toxicité connue de l’air».
Mécanisme de formation de dégradation
Nous proposons que la formation de MC et de benzène se fait via l’isoprène comme intermédiaire (Schéma 1). Les spectres GC-MS du limonène, du linalol et du myrcène ont tous montré des pics significatifs provisoirement attribués à l’isoprène, ce qui suggère que ces terpènes, les principaux terpènes de BHO, se décomposent en leurs monomères isoprènes avant d’être dégradés davantage.
Des études de la chimie atmosphérique de l’isoprène ont montré qu’il réagit avec les radicaux hydroxyle et l’O2 pour former non seulement MC et HCHO mais également la méthylvinylcétone et le 3-méthylfurane. L’analyse GC-MS de chaque terpène pur étudié a permis une identification provisoire avec une haute qualité d’appariement de MC, de méthylvinylcétone et de 3-méthylfurane, ainsi que de 1,3-butadiène et de plusieurs diènes, polyènes et aromatiques cycliques et acycliques. (Schéma 1 et
Informations à l’appui).
Limites
La principale limite de cette étude est le fait que les concentrations de MC et de benzène sont probablement sous-estimées. Une raison peut être le volume de tirage relativement important
utilisé. De plus, les valeurs de concentration dépendant de la température ont été extrapolées à
partir de myrcène, ce qui a donné le plus faible rendement de produits de dégradation de tous les
terpènes étudiés. Un autre facteur pouvant contribuer à la sous-estimation des rendements est l’inefficacité du transfert qui entraîne des pertes potentielles de terpènes et de leurs produits. Par exemple, la récupération moyenne de myrcène (8,7 ± 0,7 mg) était faible par rapport à la quantité administrée sur le clou (59,6 mg). Bien que ce faible rendement en terpènes dans l’échantillon de RMN ait été initialement attribué à leur solubilité limitée dans le DMSO-d6, des expériences de dabbing utilisant du CDC13 ont également eu un faible rendement par RMN. Cela peut ne pas être entièrement dû à la dégradation. L’inefficacité du transfert dans le dabbing a déjà été décrite.22
Conclusions
Compte tenu de la légalisation généralisée du cannabis aux États-Unis, il est impératif d’étudier la toxicologie complète de sa consommation pour orienter la politique future. Les résultats de ces études indiquent clairement que le dabbing, bien qu’il soit considéré comme une forme de vaporisation, peut en fait fournir des quantités significatives de produits de dégradation toxiques. Les difficultés rencontrées par les utilisateurs pour contrôler la température du clou font courir aux utilisateurs
le risque de s’exposer non seulement à la méthacroléine, mais aussi au benzène. De plus, l’accent mis sur les terpènes en tant qu’additifs observés récemment dans l’industrie du cannabis est très préoccupant en raison de la responsabilité oxydative de ces composés lorsqu’ils sont chauffés. Cette recherche a également des implications significatives pour les produits e-cigarette aromatisés en raison de l’utilisation extensive de terpènes comme arômes. Les recherches futures viseront également à
évaluer la contribution des terpénoïdes à la formation de substances toxiques existantes dans les cigarettes électroniques. De plus, les méthodes discutées ici seront également utilisées pour étudier davantage la dégradation des extraits de cannabis utilisés dans le dabbing et les e-cigarettes au cannabis.




