Avec un secteur du CBD européen en pleine expansion, malgré un bourbier réglementaire, des centaines d’acteurs industriels de part et d’autre de l’Atlantique sont confrontés à un avenir incertain.
Toutefois, une entreprise britannique, pionnière dans l’utilisation médicale de l’extrait de cannabidiol, aura une vision totalement différente des événements.
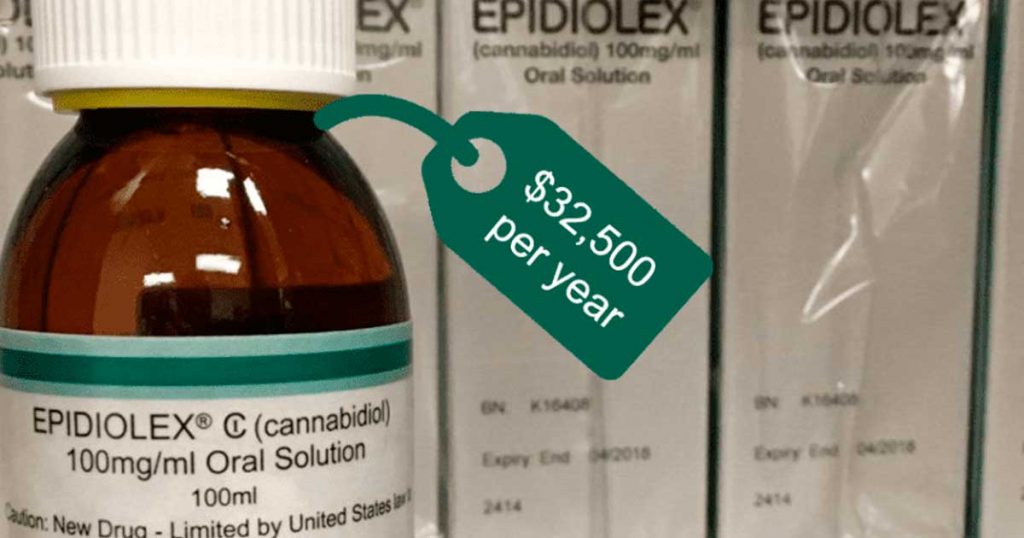
GW Pharmaceuticals, qui a été rachetée par l’entreprise irlandaise Jazz Pharmaceuticals pour 7,2 milliards de dollars en 2021, a lancé son médicament à base de CBD, l’Epidiolex, commercialisé sous le nom d’Epidyolex en Europe, en 2018.
Et, alors qu’elle a dépensé des millions de dollars en lobbying, une série d’événements concourrait à la voir dominer le secteur du CBD.
Le CBD, désormais une Novel Food ?
En 2019, l’année suivant l’approbation américaine d’Epidiolex, les régulateurs européens ont voulu intégrer le CBD dans la plateforme Novel Food. Des événements récents indiquent que d’autres interventions réglementaires sont imminentes.
Alors que l’Union européenne avait indiqué que les Novel Food seraient la voie d’accès au CBD pour les consommateurs depuis 2015, les difficultés à faire coller le CBD et ses complexités au catalogue Novel Food rendent cela de moins en moins probable.
Ces événements européens se reflètent aux États-Unis, où la Food and Drug Administration (FDA) a récemment déclaré qu’elle préférait que le CBD soit régulé par voie réglementaire plutôt que par son intermédiaire.
Mais pourquoi le CBD « bien-être » devrait être autant protégé, voire réservé à une voie médicale ? S’agit-il d’une pure coïncidence, ou d’autres facteurs sont-ils en jeu ?
Nous devons arrêter cela
C’est la deuxième hypothèse, selon Steve Oliver, fondateur et codirecteur de Canna Consultants, une société basée au Royaume-Uni. Il a déclaré à BusinessCann : c GW a vu l’industrie du CBD commencer à décoller, et ils ont dû se dire qu’il fallait arrêter ça. »
Le CBD a été découvert en 1940. Son potentiel pour l’épilepsie a, lui , été exploré dans les années 1980 par Raphaël Mechoulam et son équipe. GW, en partenariat avec l’Université de Reading, près de Londres, a travaillé sur son potentiel médical dans la réduction des crises d’épilepsie à partir de 2010.
En 2014, elle a levé plus de 148 millions de dollars auprès d’investisseurs américains pour faire avancer son traitement pour l’utilisation du CBD dans le traitement de l’épilepsie infantile sévère.
Après des essais approfondis, la FDA a approuvé l’Epidiolex pour traiter deux formes rares et sévères d’épilepsie, le syndrome de Lennox-Gastaut et le syndrome de Dravet, chez les patients âgés de plus de deux ans.

Toujours aux États-Unis, vers 2012, les parents d’enfants épileptiques ont trouvé des moyens d’accéder au CBD – qui était devenu connu sous le nom de « Hippies Disappointment » en raison de ses propriétés non psychoactives – pour traiter leur épilepsie.
Ces développements ont conduit à la croissance rapide de l’industrie du CBD des deux côtés de l’Atlantique. Elle est actuellement évaluée à plus de 6 milliards de dollars aux États-Unis et à 1,7 milliard d’euros en Europe, indique Prohibition Partners dans sa dernière analyse.
Nocivité du CBD
Peu après sa désignation en tant que Novel Food In Europe en 2019, le Comité sur la toxicité (CoT) du Royaume-Uni, qui conseille les régulateurs du CBD, l’Agence des normes alimentaires (FSA), a été chargé d’élaborer un « document de cadrage sur les effets indésirables potentiels des produits CBD ».
Des représentants de GW étaient présents lors d’une réunion du CoT pour en discuter, et certaines sections du rapport du CoT sur les effets néfastes potentiels du CBD ont été reprises mot pour mot des soumissions de GW.
Le rapport du CdT s’appuie largement sur les données fournies par GW et inclut les résultats d’études dans lesquelles le dosage de CBD administré aux participants atteignait 20 mg par kilogramme de poids corporel.
Le CoT a conclu que le CBD présente des risques pour la santé, y compris le potentiel de dommages au foie et de somnolence, même si les données de GW ont été dérivées de doses d’une ampleur significative par rapport à l’apport quotidien recommandé de CBD qui, au Royaume-Uni, est actuellement de 70 mg – ou un mg par kg de poids corporel.
À la suite d’une série d’essais sur des rongeurs, l’Association européenne du chanvre industriel (EIHA) a abaissé sa limite supérieure quotidienne recommandée à 17,5 mg (milligramme), là où le Canada s’est fixé 200mg par jour.
Le résultat des conclusions du CoT est que la FSA exige désormais des participants souhaitant rester dans l’industrie qu’ils fournissent des preuves de la sécurité du CBD. Trois ans plus tard, et malgré les millions de livres dépensés pour apaiser ces craintes, l’industrie doit encore satisfaire les régulateurs britanniques et européens.
M. Oliver a déclaré : « GW n’était pas prêt à donner au CoT l’accès à tous ses rapports d’étude, seulement à quelques uns choisis par GW. Ces rapports ont tous soulevé des problèmes de sécurité, sans indiquer si les problèmes étaient explicables ou s’ils se répétaient par la suite. Cette sélection a certainement servi les objectifs de GW en amenant l’autorité de réglementation à considérer le problème de sécurité comme un facteur nuisible pour le CBD en tant qu’aliment. »
Pour l’OMS, le CBD est sûr
En novembre 2017, le Comité d’experts sur la pharmacodépendance de l’Organisation mondiale de la santé a indiqué que le CBD « ne semble pas avoir un potentiel d’abus ou causer des dommages ».
Son document s’est basé sur un examen de la littérature existante et a conclu qu’il ne devrait pas être reclassé comme une substance nocive.
Cependant, en répondant à ces conclusions, et, dans une soumission à la FDA en 2019, GW a fait référence à ses propres recherches et a repoussé les conclusions de l’OMS.
Ce document de lobbying soutient que « le rapport de l’OMS sur le CBD soutient en fait un processus scientifique délibératif et une approche prudente de la FDA ».
Il poursuit en disant qu’il « soutient la conclusion selon laquelle la FDA devrait faire preuve de prudence lorsqu’elle examine les paramètres de la vente de CBD en tant que biens de consommation de masse ».
Plus de 2 millions de dollars de dépenses de lobbying aux États-Unis en 2019
À peu près à la même époque, par le biais de sa filiale américaine Greenwich Biosciences, GW s’était enregistrée pour faire du lobbying dans les 50 États – elle a dépensé près de 2 millions de dollars en 2019 pour faire du lobbying auprès du Congrès.
Et, c’est du Congrès que la FDA se tourne maintenant pour obtenir des directives sur la façon de traiter le CBD.
Le 26 janvier de cette année, la FDA a conclu qu’ » une nouvelle voie réglementaire pour le CBD est nécessaire pour équilibrer le désir des individus d’accéder aux produits CBD avec la surveillance réglementaire nécessaire pour gérer les risques « .
Et, dans des propos similaires à ceux du CoT au Royaume-Uni, et en référence à GW, elle a déclaré qu’en utilisant les « données Epidiolex… ainsi que les études menées et commandées par l’agence… il n’est pas évident que les produits à base de CBD puissent répondre aux normes de sécurité des compléments alimentaires ou des additifs alimentaires ».
La US Hemp Roundtable, qui représente de nombreuses entreprises de CBD, s’est déclarée « extrêmement déçue » par la décision de la FDA et l’a accusée de s’appuyer sur des études – y compris celles d’Epidiolex – qui ne montrent un risque qu’à de fortes doses, ce qui n’est pas courant dans les produits de CBD vendus au détail, ajoutant que des mesures de qualité et de sécurité sont déjà en place dans l’industrie.
Problèmes de brevets
En 2021, la FDA avait fait référence à l’Epidiolex lorsqu’elle avait rejeté les demandes de notifications de nouveaux ingrédients alimentaires pour des extraits de CBD à spectre complet présentées par les sociétés Charlotte’s Web et Irwin Naturals.
Elle a déclaré que le CBD étant l’ingrédient actif du médicament sur ordonnance approuvé Epidiolex, il ne pouvait être commercialisé en tant que complément alimentaire.
Depuis l’annonce du 26 janvier, Jazz s’est inscrit pour faire pression sur le Congrès au sujet de ses délibérations en déclarant : « Nous pensons que les patients et leurs familles sont mieux servis par des médicaments dont la sécurité et l’efficacité ont été prouvées par un solide programme de développement de médicaments et qui sont fabriqués selon les normes les plus élevées pour garantir une qualité et une identité constantes. » (Voir les réponses de Jazz ci-dessous)
Ces développements ont suivi de près l’annonce par Jazz qu’elle avait lancé une série d’actions contre un certain nombre de sociétés pharmaceutiques, les accusant de violer son brevet Epidiolex, qui, selon elle, dure jusqu’en 2039.
Cette démarche n’est pas inhabituelle pour une société pharmaceutique qui cherche à protéger ses brevets – GW possède plus de 150 brevets sur la plante de cannabis.
France et Brésil
Une autre preuve de la capacité de GW à influencer les régulateurs nationaux est apparue au Brésil à la fin de l’année dernière, où l’Epidiolex a servi de base à la décision du gouvernement d’interdire la prescription de cannabis « brut ».
La publication portugaise sur le cannabis CannaReporter rapporte que la résolution 2324/2022 « interdira aux médecins brésiliens de prescrire du CBD pour toute indication thérapeutique autre que celles pour lesquelles Epidiolex est prescrit ».
L’industrie française du CBD est sortie avec succès d’une période difficile qui comprenait l’affaire KanaVape et l’interdiction de la vente de fleurs de CBD, qui a maintenant été levée.
Alors que l’Epidiolex est disponible en France depuis quelques années, Jazz s’intéresse de plus près au marché français suite au lancement de l’expérimentation du cannabis médical dans le pays en 2021.
Elle a récemment rejoint un groupe de travail lancé par la Direction générale de la santé qui s’est réuni pour la première fois en décembre dernier.
Ce groupe de travail comprend notamment les sociétés de cannabis médical fournissant l’essai français, notamment les producteurs canadiens Aurora et Tilray, l’israélien Panaxia Pharmaceuticals et l’australien Little Green Pharma.
Benjamin Alexandre-Jeanroy, du cabinet Augur Associates basé à Paris, craint qu’à mesure que les marchés français et européen du cannabis médical se développent, les sociétés pharmaceutiques telles que Jazz modifient leur profil et étouffent la concurrence.
Il a déclaré : « Jazz tente de restreindre l’accès aux extraits à un modèle uniquement pharmaceutique, mais est-ce la bonne voie pour le cannabis, puisque son objectif est de breveter une plante ? »
« La question pour les entreprises de cannabis médical est de savoir si elles peuvent proposer un modèle plus viable. Un modèle qui soit dans l’intérêt des patients, un modèle qui permette un traitement personnalisé et le choix. »
Il a souligné que Jazz a les poches profondes et que ce niveau de capital n’est pas encore disponible pour la plupart des entreprises de cannabis médical.
La stratégie de l’innocent
Mike Morgan-Giles, directeur général du Conseil britannique de l’industrie du cannabis, a déclaré : « Nous aimerions voir le secteur pharmaceutique travailler avec l’industrie du cannabis au sens large pour aider tout le monde. Ce n’est pas un jeu à somme nulle et nous devrions travailler en collaboration. »
Nick Moreland, PDG de la société transatlantique de CBD Tenacious Labs et coprésident du groupe parlementaire britannique multipartite sur le CBD, se réjouirait également d’une telle évolution.
Cependant, il affirme que Jazz a l’intention de consommer tout le gâteau du CBD dans des démarches qu’il qualifie d’ »injustes ».

« GW, avec Jazz derrière elle, est l’entité la mieux organisée dans l’espace du cannabis et elle a un point de vue spécifique et étroit. »
« Et la raison pour laquelle ils attirent une telle négativité est qu’ils préfèrent avoir une grande part du petit gâteau plutôt qu’une partie d’un plus grand. »
« Ils n’ont pas la réputation de jouer gentiment, ou équitablement… donc une partie des études sur lesquelles on s’appuie ont été faites par des gens qui sont en avance sur le jeu en présentant ce qui se passe, par des gens qui sont très bons pour jouer les innocents. Ils n’ont pas été une force du bien ».
Il poursuit en disant que GW/Jazz a fait « un bon travail en défendant ses intérêts dans un secteur qu’ils dominent, mais ce faisant, ils gâchent la naissance de toute une industrie ».
« Sur la base du modèle Colorado, l’industrie au Royaume-Uni pourrait créer plus de 500 000 emplois et 5,5 milliards de livres de recettes fiscales annuelles. Mais la réalité de ce qu’il se passe en coulisses, de la tentative de tuer les choses à chaque étape afin d’avoir une industrie isolée avec quelques centaines d’emplois est assez déprimante », a-t-il ajouté.
En raison de cette approche unique, Jazz a laissé passer les occasions de s’engager auprès de l’industrie au sens large, un certain nombre d’organismes représentatifs affirmant que leurs tentatives d’ouverture du dialogue se sont heurtées à une réponse muette.
Le CBD va-t-il devenir un médicament ?
La FDA a identifié la voie médicale comme une possible voie d’accès pour l’industrie américaine du CBD, et l’UE a une fois de plus stoppé le processus de Novel Food car elle reste préoccupée par la sécurité du CBD.
Au Royaume-Uni, un rapport datant de 2021, auquel le gouvernement actuel n’a pas encore donné suite, a suggéré que le CBD soit considéré comme un médicament en vente libre (OTC).
Alors que les médicaments OTC populaires tels que les analgésiques et les médicaments contre la toux sont largement disponibles, si cela s’avère être le cas pour Epidiolex, cela fera le jeu de Jazz.
M. Oliver a ajouté : « Jazz cherchant à maintenir ses brevets jusqu’en 2039, il est fort possible qu’il domine l’industrie du CBD pendant la prochaine décennie. »
« Cela aura un impact majeur sur le secteur du CBD, qui sera dominé par Jazz, ce qui ne laissera que ceux qui ont les poches très profondes et la capacité de contrer ses mouvements agressifs par le biais des tribunaux. »
Prenant l’exemple du Royaume-Uni, il ajoute : « Si la situation ne change pas, le CBD sera de plus en plus placé sous les auspices du ministère de la Santé et des Soins sociaux et de l’Agence de réglementation des médicaments et des produits de santé, et ne sera disponible que sous forme d’isolat en vente libre, sans aucune trace de THC. »
M. Moreland a ajouté : « L’absence d’une définition claire de ce qui est un véritable médicament et de ce qui est des gens qui essaient de faire levier sur une ligne d’argumentation légitime en médecine dans des domaines où elle ne s’applique pas, mais qui s’emboîte bien, est préoccupante. »
Un autre haut responsable de l’industrie britannique, qui a choisi de ne pas être nommé, a ajouté : « Si Jazz a dépensé plus de 7 milliards de dollars pour GW, il voudra les récupérer, et son modus operandi consistera donc à étouffer la concurrence et à maintenir un monopole ».
L’investissement substantiel de GW dans ses deux médicaments à base de cannabis – Sativex et Epidiolex – et leur distribution par le biais de systèmes de santé remboursés en Europe et aux États-Unis, se traduisent par un prix de plus de 30 000 dollars par an, soit beaucoup plus que l’utilisation d’une année de produits de bien-être au CBD vendus au détail.
Les ventes totales d’Epidiolex ont atteint 464 millions de dollars en 2021 et devraient avoir augmenté d’au moins 20 % en 2022.
Réponse de Jazz à BusinessCann
BusinessCann a posé les questions suivantes à Jazz et a reçu les réponses suivantes
1. Les données relatives à l’Epidiolex sont-elles pertinentes pour le CBD grand public ?
2. Jazz communiquera-t-elle d’autres données aux organismes de réglementation concernant ses travaux sur l’Epidiolex ?
3. Certains disent que les données communiquées au Comité britannique sur la toxicité ont soulevé des problèmes de sécurité, sans indiquer si ces problèmes étaient explicables ou s’ils se sont répétés par la suite ?
4. Combien Jazz a-t-elle dépensé pour ses activités de lobbying au Royaume-Uni, aux États-Unis et dans le reste du monde ?
5. Le CBD est-il mieux traité comme un aliment ou un médicament ?
Réponse aux questions 1, 2, 3 et 4
Jazz est une société biopharmaceutique internationale qui possède un portefeuille diversifié de médicaments commercialisés et de nouveaux produits candidats dans ses deux domaines thérapeutiques clés, les neurosciences et l’oncologie.
En tant que leader mondial dans le domaine de la science des cannabinoïdes et des médicaments, Jazz reconnaît qu’elle a un rôle important à jouer pour informer l’environnement externe afin de réaliser le plein potentiel médical de la plante de cannabis et des cannabinoïdes, tout en tenant compte de la sécurité des patients et de la santé publique.
Nous prenons cette responsabilité très au sérieux. Cela peut inclure la fourniture d’informations précises et fondées sur des preuves concernant la science des cannabinoïdes, la médecine et la réglementation, ainsi que le soutien aux décideurs politiques et à la communauté des soins de santé pour faciliter leur travail.
En tant qu’entreprise responsable ayant à cœur les meilleurs intérêts des patients et de la santé publique, nous soutenons tout effort visant à générer des données supplémentaires permettant de mieux combler les lacunes actuelles en matière de sécurité et de qualité des produits de consommation contenant du CBD, et à évaluer ces données par le biais d’un processus réglementaire solide.
Des preuves scientifiques plus solides sont nécessaires pour que les organismes de réglementation puissent évaluer la sécurité des produits contenant du CBD utilisés sans ordonnance et sans la supervision d’un médecin.
Nous soutenons et demandons instamment la production de données supplémentaires par d’autres entreprises afin de combler les lacunes actuelles en matière de sécurité et de qualité de ces produits.
Détails supplémentaires concernant la question 2
En ce qui concerne l’Epidyolex et son statut de médicament autorisé à base de cannabinoïdes, nous croyons fermement à notre responsabilité et à notre obligation permanentes de fournir des données supplémentaires aux organismes de réglementation médicale et entretenons donc un dialogue régulier avec ces organisations.
Ces données supplémentaires peuvent être partagées de plusieurs façons, notamment par des études de sécurité post-autorisation ou par un engagement dans des registres de sécurité.
Réponse à la question 5
Qu’il s’agisse d’un aliment ou d’un médicament, nous croyons que les patients et les consommateurs méritent d’avoir accès à des produits bien tolérés et bien documentés.
Jazz croit passionnément aux bienfaits thérapeutiques potentiels de la plante de cannabis et croit fermement que les médicaments cannabinoïdes ont le potentiel d’améliorer la vie des patients et des familles. Pour les consommateurs qui cherchent à utiliser des produits de consommation contenant de la CBD, nous croyons que des preuves scientifiques plus solides sont nécessaires pour que les organismes de réglementation puissent évaluer la sécurité des produits contenant de la CBD pour une utilisation sans ordonnance et sans la supervision d’un médecin.
Nous soutenons et demandons instamment la production de données supplémentaires par d’autres entreprises afin de combler les lacunes actuelles en matière de sécurité et de qualité de ces produits.
En ce qui concerne l’utilisation des médicaments à base de cannabinoïdes, nous espérons que beaucoup plus de patients bénéficieront de ces médicaments dans les années à venir, mais selon nous, la meilleure façon d’y parvenir est de procéder à des essais contrôlés randomisés et d’appliquer la rigueur et les normes exigées par le processus d’obtention d’une approbation réglementaire [une autorisation de mise sur le marché].
Les médicaments à base de cannabinoïdes qui ont franchi ces étapes importantes auront un profil de sécurité et d’efficacité bien établi, répondront aux normes de qualité et de stabilité et contiendront des concentrations constantes de médicament dans chaque lot.
Informations supplémentaires sur la plateforme cannabinoïde de Jazz
La plateforme de cannabinoïdes, dans laquelle Jazz continue d’investir à la suite de l’acquisition de GW Pharmaceuticals, a été créée en réponse directe aux besoins médicaux non satisfaits d’un groupe de patients britanniques atteints de sclérose en plaques (SEP), qui, à l’époque, faisaient l’objet de poursuites pour automédication avec du cannabis de rue.
Ces dernières années, GW, et maintenant Jazz, ont exploré le potentiel des médicaments à base de cannabis pour aider les personnes atteintes de formes graves et potentiellement mortelles d’épilepsie infantile.
L’équipe a passé les deux dernières décennies à mener des enquêtes scientifiques rigoureuses et des essais cliniques approfondis pour découvrir le potentiel thérapeutique de la plante.
Cependant, nos principes fondateurs continuent de guider notre travail et répondre aux besoins des patients reste notre objectif principal. Nous croyons toujours passionnément au potentiel des médicaments à base de cannabinoïdes pour améliorer la vie des patients et de leurs familles.
Jazz est un défenseur de la voie pharmaceutique éprouvée des essais cliniques et des autorisations réglementaires pour le CBD et le cannabis. Cette voie permet de comprendre les risques et les avantages de ces composés pour les patients et d’établir les trois piliers pharmaceutiques fondamentaux que sont la qualité, la sécurité et l’efficacité. Selon nous, c’est la meilleure façon de servir les intérêts des patients et des professionnels de la santé.
Sans un ensemble complet d’études précliniques et cliniques, nous n’avons aucune idée de la toxicité d’un produit, de ses interactions médicamenteuses, de son potentiel d’abus, de ses effets secondaires et de son dosage sûr, entre autres. Cela entraîne des risques inconnus pour les professionnels de la santé et les patients eux-mêmes.
Les autorisations réglementaires que nous avons obtenues aux États-Unis, en Europe et dans le monde entier démontrent que les médicaments à base de cannabis extrait de plantes, qu’ils soient complexes ou composés d’un seul cannabinoïde, peuvent être acheminés avec succès par la voie réglementaire pharmaceutique établie et être ensuite remboursés, et nous encourageons les autres à suivre notre exemple.
Le remboursement de nos médicaments par les systèmes de santé et les payeurs du monde entier démontre que, si elles disposent des preuves de haute qualité adéquates, les autorités sanitaires assureront l’accès aux médicaments à base de cannabinoïdes pour les patients qui pourraient en bénéficier.
Source : newsweed.fr
